Alogeni: proprietà fisiche, proprietà chimiche. L'uso di alogeni e loro composti
Si trovano alogeni nella tavola periodicaa sinistra dei gas nobili. Questi cinque elementi non metallici tossici sono inclusi nel gruppo 7 della tavola periodica. Questi includono fluoro, cloro, bromo, iodio e astato. Sebbene l'astat sia radioattivo e abbia solo isotopi di breve durata, si comporta come lo iodio, ed è spesso considerato alogeno. Poiché gli elementi alogeni hanno sette elettroni di valenza, hanno bisogno di un solo elettrone aggiuntivo per formare un ottetto completo. Questa caratteristica li rende più attivi di altri gruppi di non metalli.
Caratteristiche generali
Gli alogeni formano molecole biatomiche (della forma X2, dove X è un atomo di alogeno) - stabileforma di esistenza di alogeni sotto forma di elementi liberi. I legami di queste molecole biatomiche sono non polari, covalenti e singoli. Le proprietà chimiche degli alogeni consentono loro di unirsi facilmente alla maggior parte degli elementi, quindi non si verificano mai in natura. Il fluoruro è l'alogeno più attivo e astat è il meno attivo.
Tutti gli alogeni formano sali del gruppo I con proprietà simili. In questi composti gli alogeni sono presenti sotto forma di anioni di alogenuri con una carica di -1 (per esempio, Cl-, Fr-). L'end-id indica la presenza di alogenuri-anioni; per esempio Cl- si chiama "cloruro".
Inoltre, le proprietà chimiche degli alogenipermettere loro di agire come ossidanti - ossidare i metalli. La maggior parte delle reazioni chimiche in cui sono coinvolti gli alogeni sono la riduzione dell'ossidazione in una soluzione acquosa. Gli alogeni formano singoli legami con carbonio o azoto in composti organici, dove il loro grado di ossidazione (CO) è -1. Quando l'atomo di alogeno viene sostituito da un atomo di idrogeno legato in modo covalente nel composto organico, il prefisso halo può essere utilizzato in senso generale, o il prefisso fluoro-, cloro-, bromo-, iodio per specifici alogeni. Gli elementi alogeni possono avere una connessione incrociata con la formazione di molecole biatomiche con singoli legami covalenti polari.
Cloro (cl2) divenne il primo alogeno scoperto nel 1774, poi fu scoperto lo iodio (I2), bromo (fr2), fluoro (F2) e astat (At, è stato scoperto per ultimo, nel 1940). Il nome "alogeno" deriva dalle radici greche hal- ("sale") e -gen ("forma"). Insieme, queste parole significano "sale-forming", sottolineando il fatto che gli alogeni, reagendo con i metalli, formano sali. Galite è il nome di salgemma, un minerale naturale costituito da cloruro di sodio (NaCl). Infine, gli alogeni vengono utilizzati nella vita di tutti i giorni: il fluoro si trova nei dentifrici, il cloro disinfetta l'acqua potabile e lo iodio favorisce la produzione di ormoni tiroidei.

Elementi chimici
Il fluoro - un elemento con numero atomico 9, è denotato dasimbolo F. Il fluoro elementare fu scoperto per la prima volta nel 1886 separandolo dall'acido fluoridrico. Nello stato libero, il fluoro esiste sotto forma di una molecola biatomica (F2) ed è l'alogeno più comunenella crosta terrestre. Il fluoro è l'elemento più elettronegativo nella tavola periodica. A temperatura ambiente è un gas giallo pallido. Il fluoro ha anche un raggio atomico relativamente piccolo. La sua CO-1, ad eccezione di uno stato di diatomia elementare, in cui il suo grado di ossidazione è pari a zero. Il fluoro è estremamente attivo chimicamente e interagisce direttamente con tutti gli elementi tranne l'elio (He), il neon (Ne) e l'argon (Ar). In una soluzione di H2O, l'acido fluoridrico (HF) è deboleL'acido. Sebbene il fluoro sia fortemente elettronegativo, la sua elettronegatività non determina l'acidità; L'HF è un acido debole a causa del fatto che lo ione fluoro è basico (pH> 7). Inoltre, il fluoro produce ossidanti molto potenti. Ad esempio, il fluoro può reagire con un gas inerte con lo xenon e forma un forte ossidante difluoruro di xeno (XeF2). Il fluoro ha molti usi.

Il cloro è un elemento con numero atomico 17 e simbolo chimico Cl. Trovato nel 1774 separandolo dall'acido cloridrico. Nel suo stato elementare, forma una molecola biatomica, Cl2. Il cloro ha diversi CO: -1, +1, 3, 5 e 7. A temperatura ambiente è un gas verde chiaro. Poiché il legame che si forma tra i due atomi di cloro è debole, la molecola di Cl2 ha una capacità molto elevata di aderirecollegamento. Il cloro reagisce con i metalli per formare sali, che sono chiamati cloruri. Gli ioni di cloro sono gli ioni più comuni, sono contenuti nell'acqua di mare. Il cloro ha anche due isotopi: 35Cl e 37Cl. Il cloruro di sodio è il composto più comune di tutti i cloruri.
Il bromo è un elemento chimico con numero atomico 35 e il simbolo Br. Fu scoperto per la prima volta nel 1826. Nella sua forma elementare, il bromo è un bromo biatomico2. A temperatura ambiente, è un liquido bruno-rossastro. Il suo CO è -1, + 1, 3, 4 e 5. Il bromo è più attivo dello iodio, ma meno attivo del cloro. Inoltre, il bromo ha due isotopi: 79Br e 81Br. Il bromo si trova sotto forma di sali di bromuro disciolti nell'acqua di mare. Negli ultimi anni, la produzione mondiale di bromuro è aumentata in modo significativo a causa della sua disponibilità e lunga durata. Come altri alogeni, il bromo è un agente ossidante e molto tossico.

Lo iodio è un elemento chimico con numero atomico 53 e simbolo I. Lo iodio presenta stati di ossidazione: -1, +1, +5 e +7. Esiste sotto forma di una molecola biatomica, I2. A temperatura ambiente è una sostanza solida di colore viola. Lo iodio ha un isotopo stabile - 127I. Fu scoperto per la prima volta nel 1811. con l'aiuto di alghe e acido solforico. Attualmente, gli ioni di iodio possono essere isolati nell'acqua di mare. Nonostante il fatto che lo iodio non sia molto solubile in acqua, la sua solubilità può aumentare con l'uso di singoli ioduri. Lo iodio gioca un ruolo importante nel corpo, partecipando alla produzione di ormoni tiroidei.

Astat è un elemento radioattivo con un numero atomico85 e il simbolo At. I suoi possibili stati di ossidazione sono: -1, +1, 3, 5 e 7. L'unico alogeno che non sia una molecola biatomica. In condizioni normali è un solido metallico di colore nero. Astat è un elemento molto raro, così poco si sa a riguardo. Inoltre, l'astato ha un'emivita molto breve, non più lunga di alcune ore. Ottenuto nel 1940 come risultato della sintesi. Si ritiene che l'astato sia simile allo iodio. Si distingue per le sue proprietà metalliche.
La tabella seguente mostra la struttura degli atomi di alogeno, la struttura dello strato esterno di elettroni.
alogeno | La configurazione di elettroni |
fluoro | 1s2 2s2 2p5 |
cloro | 3s2 3p5 |
bromo | 3d10 4s2 4p5 |
iodio | 4d10 5s2 5p5 |
astato | 4f14 5d10 6s2 6p5 |
Una struttura simile dello strato esterno di elettroni fa sì che le proprietà fisiche e chimiche degli alogeni siano simili. Allo stesso tempo, confrontando questi elementi, si osservano anche differenze.
Proprietà periodiche nel gruppo alogeno
Le proprietà fisiche delle semplici sostanze alogene variano con l'aumento del numero atomico dell'elemento. Per una migliore comprensione e una maggiore chiarezza, ti offriamo diverse tabelle.
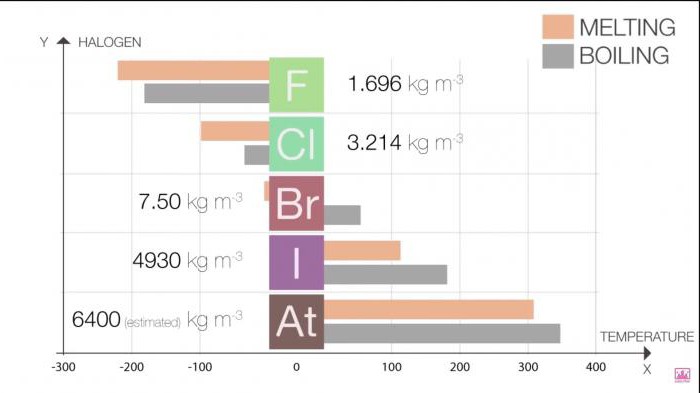
I punti di fusione e di ebollizione nel gruppo aumentano con la crescita della dimensione della molecola (F <Cl <Br <I <At). Questo aumento significa un aumento della forza di Van der Waals.
Tabella 1. Alogeni. Proprietà fisiche: punto di fusione e punto di ebollizione
alogeno | Punto di fusione (˚C) | Il punto di ebollizione (˚C) |
fluoro | -220 | -188 |
cloro | -101 | -35 |
bromo | -7.2 | 58.8 |
iodio | 114 | 184 |
astato | 302 | 337 |
- Il raggio atomico aumenta.
La dimensione del nucleo aumenta (F <Cl <Br <I <At),poiché aumenta il numero di protoni e neutroni. Inoltre, con ogni periodo, vengono aggiunti sempre più livelli di energia. Ciò porta ad un maggiore orbitale e, di conseguenza, ad un aumento del raggio dell'atomo.
Tabella 2. Alogeni. Proprietà fisiche: raggi atomici
alogeno | Raggio covalente (pm) | Ionico (X-) raggio (pm) |
fluoro | 71 | 133 |
cloro | 99 | 181 |
bromo | 114 | 196 |
iodio | 133 | 220 |
astato | 150 |
- L'energia di ionizzazione diminuisce.
Se gli elettroni di valenza esterni non sono localizzativicino al nucleo, quindi per rimuoverlo non richiede molta energia. Pertanto, l'energia necessaria per estrarre un elettrone esterno non è così alta nella parte inferiore del gruppo di elementi, poiché qui vi sono più livelli di energia. Inoltre, l'alta energia di ionizzazione fa sì che la cellula esibisca qualità non metalliche. Lo iodio e il display astat mostrano proprietà metalliche, poiché l'energia di ionizzazione diminuisce (A <I <Br <Cl <F).
Tabella 3. Alogeni. Proprietà fisiche: energia di ionizzazione
alogeno | L'energia di ionizzazione (kJ / mol) |
fluoro | 1681 |
cloro | 1251 |
bromo | 1140 |
iodio | 1008 |
astato | 890 ± 40 |
- L'elettronegatività diminuisce.
Il numero di elettroni di valenza in un atomo aumenta conaumento dei livelli di energia a livelli progressivamente più bassi. Gli elettroni sono progressivamente più lontani dal nucleo; Pertanto, il nucleo e gli elettroni non sono attratti l'uno dall'altro. Si osserva un aumento dello screening. Pertanto, l'elettronegatività diminuisce con l'aumentare del periodo (A <I <Br <Cl <F).
Tabella 4. Alogeni. Proprietà fisiche: elettronegatività
alogeno | elettronegatività |
fluoro | 4.0 |
cloro | 3.0 |
bromo | 2.8 |
iodio | 2.5 |
astato | 2.2 |
- L'affinità per un elettrone diminuisce.
Poiché la dimensione dell'atomo aumenta all'aumentareperiodo, l'affinità per l'elettrone, di regola, diminuisce (B <I <Br <F <Cl). L'eccezione è il fluoro, la cui affinità è inferiore a quella del cloro. Questo può essere spiegato dalla minore dimensione del fluoro rispetto al cloro.
Tabella 5. L'affinità degli alogeni per un elettrone
alogeno | Affinità per l'elettrone (kJ / mol) |
fluoro | -328.0 |
cloro | -349.0 |
bromo | -324.6 |
iodio | -295.2 |
astato | -270.1 |
- La reattività degli elementi diminuisce.
La reattività degli alogeni diminuisce con la crescitaperiodo (A <I <Br <Cl <F). Ciò è dovuto all'aumento del raggio dell'atomo con l'aumento dei livelli di energia degli elettroni. Ciò riduce l'attrazione degli elettroni di valenza di altri atomi, riducendo la reattività. Questa diminuzione si verifica anche a causa della caduta dell'elettronegatività con un periodo crescente, che riduce anche l'attrazione degli elettroni. Inoltre, all'aumentare della dimensione dell'atomo, diminuisce anche la capacità di ossidazione.
Chimica inorganica. Idrogeno + alogeni
L'alogenuro si forma quando l'alogeno reagisce con un altro elemento meno elettronegativo per formare un composto binario. L'idrogeno reagisce con alogeni per formare alogenuri del tipo HX:
- acido fluoridrico HF;
- acido cloridrico HCl;
- bromidrato HBr;
- idrogeno idruro HI.
Gli alogenuri di idrogeno si sciolgono facilmente in acqua con la formazione di un acido idroalico (idrofluorico, cloridrico, bromidrico, idroiodico). Le proprietà di questi acidi sono riportate di seguito.
Gli acidi sono formati dalla seguente reazione: HX (aq) + H2O (l) → X- (aq) + H3O+ (Aq).
Tutti gli alogenuri di idrogeno formano acidi forti, ad eccezione dell'HF.
L'acidità degli acidi idrosalici aumenta: HF <HCl <HBr <HI.
L'acido fluoridrico è in grado di incidere a lungo il vetro e alcuni fluoruri inorganici.
Può sembrare illogico che l'HF sial'acido idroalico più debole, dal momento che il fluoro ha la più alta elettronegatività. Tuttavia, il legame H-F è molto forte, a causa del quale l'acido è molto debole. Un legame forte è determinato dalla breve lunghezza del legame e dall'elevata energia di dissociazione. Di tutti gli alogenuri di idrogeno, l'HF ha la lunghezza di legame più corta e l'energia di legame di dissociazione più grande.
Oxoacids alogeno
Gli ossidi di alogeno sono acidi con atomi di idrogeno, ossigeno e alogeno. La loro acidità può essere determinata dall'analisi della struttura. Gli oxoacidi alogeni sono elencati di seguito:
- Acido ipocloroso HOCl.
- Acido cloridrico HClO2.
- Acido cloridrico HClO3.
- Acido cloridrico HClO4.
- Acido ipobutirrico HOBr.
- Acido bromonico HBrO3.
- Acido bromico HBrO4.
- HOI acido di iodio.
- Acido iodonico HIO3.
- Acido metionico HIO4, H5IO6.
In ciascuno di questi acidi, il protone è legato all'atomoossigeno, quindi confrontare le lunghezze dei legami protonici è inutile qui. Il ruolo dominante qui è l'elettronegatività. L'attività dell'acido aumenta con il numero di atomi di ossigeno legati all'atomo centrale.
Aspetto e condizione della sostanza
Le principali proprietà fisiche degli alogeni possono essere riassunte nella seguente tabella.
Lo stato della sostanza (a temperatura ambiente) | alogeno | aspetto |
azienda | iodio | porpora |
astato | nero | |
liquido | bromo | ruggine |
gassoso | fluoro | pallido giallo-marrone |
cloro | verde pallido |
Spiegazione di apparenza
Il colore degli alogeni è il risultato dell'assorbimentomolecole di luce visibile, che provocano l'eccitazione degli elettroni. Il fluoro assorbe la luce viola e, quindi, appare giallo chiaro. Lo iodio, al contrario, assorbe la luce gialla e appare viola (giallo e viola - colori complementari). Il colore degli alogeni diventa più scuro man mano che il periodo aumenta.

In contenitori chiusi, il bromo liquido e lo iodio solido sono in equilibrio con i loro vapori, che possono essere osservati sotto forma di gas colorato.
Anche se l'ignoto colore astato, si ritiene che dovrebbe essere un iodio più scura (t. E. Nero) secondo il modello osservato.
Ora, se ti viene chiesto: "Caratterizza le proprietà fisiche degli alogeni", avrai qualcosa da dire.
Il grado di ossidazione degli alogeni nei composti
Il grado di ossidazione è spesso usato al posto diil concetto di "valenza alogena". Di regola, il grado di ossidazione è -1. Ma se l'alogeno è legato all'ossigeno o ad un altro alogeno, può assumere altri stati: CO oxygen-2 ha la priorità. Nel caso di due diversi atomi di alogeno uniti, l'atomo più elettronegativo prevale e prende CO-1.
Ad esempio, in cloruro di iodio (ICl), il cloro ha CO-1 e iodio +1. Il cloro è più elettronegativo dello iodio, quindi il suo CO è -1.
In acido bromico (HBrO4) l'ossigeno ha CO-8 (-2 x 4 atomi = -8). L'idrogeno ha uno stato di ossidazione totale di +1. L'aggiunta di questi valori fornisce CO-7. Poiché il CO finale del composto deve essere zero, il CO di bromo è +7.
La terza eccezione alla regola è il grado di ossidazione dell'alogeno in forma elementare (X2), dove il suo CO è zero.
alogeno | CO in composti |
fluoro | -1 |
cloro | -1, +1, +3, +5, +7 |
bromo | -1, +1, +3, +4, +5 |
iodio | -1, +1, +5, +7 |
astato | -1, +1, +3, +5, +7 |
Perché il CO di fluoro è sempre -1?
L'elettronegatività aumenta con la crescitaperiodo. Pertanto, il fluoro ha la più alta elettronegatività di tutti gli elementi, il che è confermato dalla sua posizione nella tavola periodica. La sua configurazione elettronica è 1s2 2s2 2p5. Se il fluoro ottiene un altro elettrone, l'estremoGli orbitali p sono completamente riempiti e costituiscono un ottetto completo. Poiché il fluoro ha un'elevata elettronegatività, può facilmente prendere un elettrone da un atomo vicino. Il fluoro in questo caso è isoelettronico a un gas inerte (con otto elettroni di valenza), tutti i suoi orbitali esterni sono riempiti. In questo stato, il fluoro è molto più stabile.
Preparazione e uso di alogeni
In natura, gli alogeni sono nello stato degli anioni,pertanto, gli alogeni liberi sono ottenuti per ossidazione mediante elettrolisi o mediante agenti ossidanti. Ad esempio, il cloro viene prodotto per idrolisi di una soluzione di sale comune. L'uso di alogeni e loro composti è vario.
- fluoro. Nonostante il fatto che il fluoro sia molto reattivo, lo faè usato in molte aree dell'industria. Ad esempio, è un componente chiave del politetrafluoroetilene (Teflon) e di alcuni altri fluoropolimeri. I clorofluorocarburi sono sostanze chimiche organiche precedentemente utilizzate come refrigeranti e propellenti negli aerosol. Il loro uso si è interrotto a causa del loro possibile impatto sull'ambiente. Sono stati sostituiti da idroclorofluorocarburi. Il fluoro è aggiunto al dentifricio (SnF2) e acqua potabile (NaF) per prevenire la carie. Questo alogeno è contenuto nell'argilla usata per fabbricare alcuni tipi di ceramica (LiF), è usato nell'ingegneria dell'energia nucleare (UF6), per la preparazione dell'antibiotico fluorochinolone, alluminio (Na3AlF6), per l'isolamento di apparecchiature ad alta tensione (SF6).
- cloro trovato anche una varietà di applicazioni. È usato per la disinfezione dell'acqua potabile e delle piscine. L'ipoclorito di sodio (NaClO) è il componente principale della candeggina. L'acido cloridrico è ampiamente usato nell'industria e nei laboratori. Il cloro è presente in polivinilcloruro (PVC) e altri polimeri, che vengono utilizzati per isolare cablaggi, tubi ed elettronica. Inoltre, il cloro era anche utile nell'industria farmaceutica. I farmaci contenenti cloro sono usati per trattare infezioni, allergie e diabete. La forma neutra di cloridrato è un componente di molti farmaci. Il cloro viene anche utilizzato per la sterilizzazione delle apparecchiature ospedaliere e la disinfezione. In agricoltura, il cloro è un componente di molti pesticidi commerciali: il DDT (diclorodifeniltricloroetano) è stato utilizzato come insetticida agricolo, ma il suo uso è stato interrotto.

- bromo, a causa della sua incombustibilità, è usato persoppressione della combustione. Si trova anche nel bromuro di metile, un pesticida usato per conservare le colture e inibire i batteri. Tuttavia, l'uso eccessivo di bromuro di metile è stato interrotto a causa del suo impatto sullo strato di ozono. Il bromo è utilizzato nella produzione di benzina, pellicole fotografiche, estintori, farmaci per il trattamento della polmonite e il morbo di Alzheimer.
- iodio svolge un ruolo importante nel corretto funzionamento dighiandola tiroidea. Se il corpo non ottiene abbastanza iodio, c'è un aumento della ghiandola tiroidea. Per evitare il gozzo, questo alogeno viene aggiunto al sale da cucina. Lo iodio è anche usato come antisettico. Lo iodio si trova nelle soluzioni utilizzate per pulire le ferite aperte, nonché negli spray disinfettanti. Inoltre, lo ioduro d'argento è importante per la fotografia.
- astato - alogeno radioattivo e terre rare, quindi non viene utilizzato da nessun'altra parte. Tuttavia, si ritiene che questo elemento possa aiutare lo iodio nella regolazione degli ormoni tiroidei.




